癌症相关成纤维细胞(Cancer associated fibroblasts,CAFs)通过促进纤维化和免疫抑制活性在肝细胞癌(Hepatocellular carcinoma, HCC)发生、发展和转移中起着关键作用。因此,寻找克服这一基质-免疫屏障的有效药物组合成为肝细胞癌治疗领域的关键挑战。近日,珠江医院方驰华研究团队发布最新研究成果,有望为HCC以及纤维化实体瘤患者带来更精准和高效的治疗方案。

纳米平台构建及突破纤维屏障增强免疫模式图
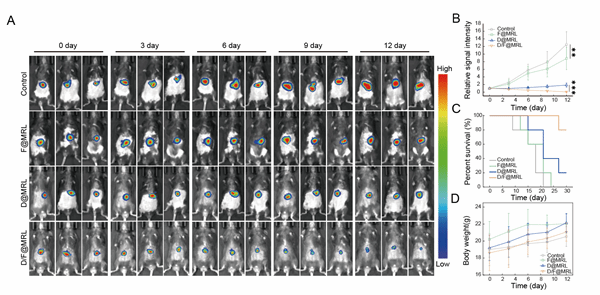
联合纳米平台对异种移植原位瘤小鼠(CDX)模型有着显著的肿瘤抑制效果和总体生存期的延长作用
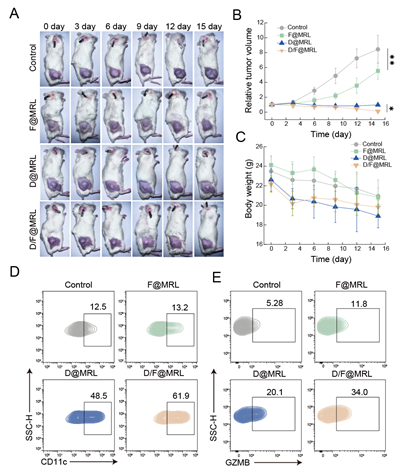
联合纳米平台对人源化免疫患者来源的异种移植模型(PDX) 小鼠具有明显肿瘤抑制和免疫激活效果
方驰华团队通过调研,确认了地高辛(digoxin,Dig)是抑制HCC进展的潜在药物候选,其不仅可以通过阻滞肿瘤细胞周期进而诱导细胞凋亡,而且产生直接肿瘤杀伤作用。其能够诱导ICD,进而促进树突状细胞(dendritic cell ,DC)的成熟,并激活CD8+ T细胞的反应,这一过程增强了抗肿瘤免疫,但是管理Dig的毒性是其临床应用中的一个重要问题。
基于这一发现,研究团队创新性地结合纳米技术开发了一种负载地高辛和PD-L1降解纳米纤维(NFs)的MMP-2响应杂化脂质体(D/F@MRL)。这是一种基质-免疫协同靶向纳米平台,能够实现CAF重编程与免疫激活的时空协调。在D/F@MRL中,采用了金属基质蛋白酶-2(MMP-2)响应型杂化脂质体(MRL),共负载Dig和PD-L1降解纳米纤维。当D/F@MRL遇到富含MMP-2的HCC基质时,脂质体发生酶切反应,从而使Dig和NFs在HCC微环境中靶向释放。从机制上讲,Dig抑制了CAF中SMAD3的磷酸化,而PD-L1的降解使TGF-β受体不稳定,协同沉默TGF-β/Smad信号通路,从而重编程CAF。这种组合不仅破坏了纤维化屏障,还创造了一个前馈循环,进一步增强了药物渗透,同时加强了Dig诱导的免疫原性细胞死亡(Immunogenic cell death,ICD)和PD-L1降解驱动的免疫激活。
方驰华介绍,这种协同药物策略克服了HCC中由纤维化引起的免疫抑制,实现了药物在肿瘤微环境中的精准递送,同时在CDX和免疫人源化PDX模型中均展现优异的治疗潜力。这一研究成果有望为HCC以及纤维化实体瘤患者带来更精准和高效的治疗方案。该研究成果在《Journal of Controlled Release》期刊上发表,题为“Nanoparticle-mediated dual targeting of stromal and immune componentsto overcome fibrotic and immunosuppressive barriers in hepatocellular carcinoma”。文章唯一通讯作者为珠江医院方驰华,第一作者为肝胆一科尹祥意博士。