我校基础医学院病理学系依托广东省分子肿瘤病理重点实验室,长期致力于肿瘤分子致病机制及新型诊疗靶点的发掘、鉴定与临床转化研究,取得了很多高水平成果。在刚刚过去的2018年度更是硕果累累、捷报频传,连续在国际顶级学术期刊《Nature communications》上刊登四项重要研究成果,在肿瘤演进与治疗抵抗领域取得了突破性的进展,达到我系短期内连续发表高质量科研成果的历史之最。
一
12月19日,我校基础医学院病理学系梁莉在Nature Communications杂志在线发表题为“Cancer-derived Exosomal MiR-25-3p Promotes Pre-metastatic Niche Formation by Inducing Vascular Permeability and Angiogenesis”的研究论文,揭示了结直肠癌来源外泌体中的miR-25在结直肠癌转移中的重要作用(https://www.nature.com/articles/s41467-018-07810-w)

论文首页
本研究中,研究人员发现结直肠癌来源外泌体中的miR-25可以通过外泌体途径转运到血管内皮细胞中从而通过靶向内皮细胞中KLF2和KLF4促进血管通透性和血管形成。此外,研究人员还发现外泌体中的miR-25通过诱导血管渗透介导了裸鼠预转移微环境形成。最后,该研究的临床数据表明结直肠癌病人的外周血循环外泌体可能可以作为一个血检标志物用于预测结直肠癌转移。
总体来说,该研究揭示了miR-25在结直肠癌诱导的肝肺预转移微环境形成中的重要作用,为结直肠癌转移的诊断、预后评估及干预提供了新的靶点。
南方医科大学病理学系梁莉为论文的通讯作者,曾志诚、李妤玲、潘阳建为文章的共同一作,该课题受到国家自然科学基金委和科技部的经费支持。
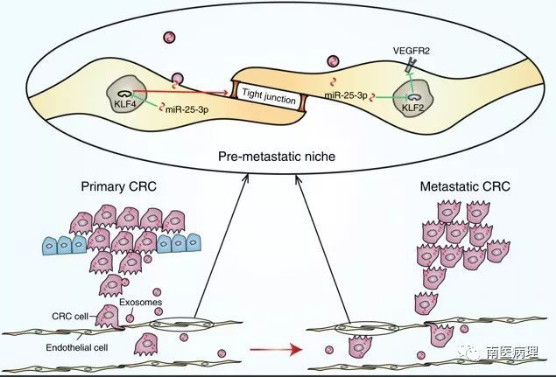
结直肠癌来源外泌体调控预转移微环境模式图
二
12月5日,南方医科大学基础医学院病理学系石坚课题组在肿瘤药物抵抗机制研究中取得进展,研究成果以“Targeting the BRD4/FOXO3a/CDK6 axis sensitizes AKT inhibition in luminal breast cancer”为题发表在《Nature communications》期刊上,石坚教授为共同通讯作者。

论文首页
PI3K/AKT信号通路在调控肿瘤细胞生长、存活和代谢过程中扮演着关键角色。目前多个临床试验评估了超过30种靶向PI3K/AKT通路的药物在乳腺癌和其他癌症治疗中的功效,尽管这些小分子药物显示出明显的抑制癌细胞生长和诱导凋亡的效果,但癌细胞对这种单一疗法的反应是有限的,时常伴随有药物抵抗的出现。
该研究发现AKT抑制剂阻断SIRT6蛋白磷酸化,破坏Foxo3a/SIRT6的结合,诱导Foxo3a的赖氨酸乙酰化并促进其与BRD4结合,最终诱导CDK6基因表达以抵抗AKT抑制剂的杀伤效果。体外体内实验均证实,BRD4抑制剂或者CDK6激酶抑制剂的联合使用均可极大的提高AKT抑制剂对管腔型乳腺癌细胞的杀伤作用。
该研究受到国家自然科学基金面上项目和广州市科技计划项目的资助。

管腔型乳腺癌药物抵抗机制模式图
三
7月3日,Nature旗下杂志Nature Communications在线发表了第三军医大学与我校基础医学院病理系杨魏课题组的最新合作研究成果:Monoacylglycerol lipase regulates cannabinoid receptor 2-dependent macrophage activation and cancer progression.

论文首页
异质性和可塑性是巨噬细胞的重要特征,巨噬细胞根据其功能可定义为经典活化性(促炎型)M1型和抗炎的M2型。在肿瘤微环境中,肿瘤相关巨噬细胞(Tumor associated macrophages, TAMs)也是异质性的,但更倾向于M2的表型,是肿瘤微环境免疫抑制的原因之一。然而,TAMs在肿瘤微环境中如何被诱导成M2型的机制尚不明确。近来,代谢重编程被发现是巨噬细胞表型转化的物质基础。该研究发现,MGLL (Monoacylglycerol lipase)作为脂质代谢的关键酶,负责分解单甘油酯,而肿瘤微环境通过抑制MGLL的表达,导致TAMs细胞内单甘油酯的堆积。单甘油酯中有一种特殊的脂质分子2-花生四烯酸甘油(2-AG),是内源性的大麻素信号底物。MGLL表达抑制导致2-AG的堆积,进一步激活大麻素受体CB2,激活的CB2进而通过与TLR4结合拮抗TLR4的活化,从而抑制巨噬细胞的活化,促进巨噬细胞向M2方向分化。进一步的研究还发现,通过过表达MGLL或者通过抑制剂抑制CB2的活性,可解除肿瘤微环境对TAMs活化的抑制,促使其向M1型细胞的分化,启动机体抗肿瘤免疫应答,抑制肿瘤的生长。
该研究受到国家自然科学基金面上项目和广东省自然科学基金的资助。
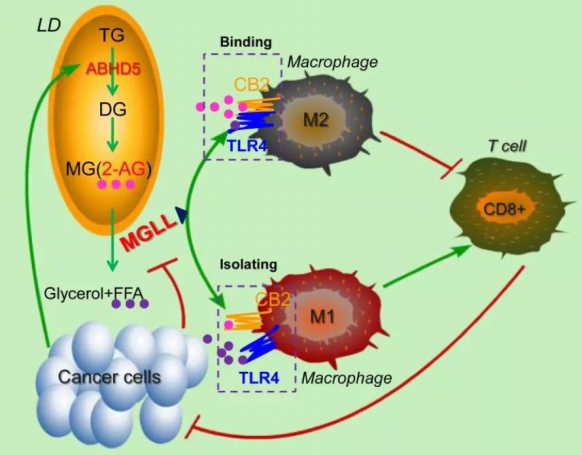
MGLL调控巨噬细胞活化和肿瘤进展机制模式图
四
2019年1月10日,Nature Communications发表了我校基础医学院病理学系张庆玲和丁彦青课题组研究成果“Mir20a/106a-WTX axis regulates RhoGDIa/CDC42 signaling and colon cancer progression”( https://www.nature.com/articles/s41467-018-07998-x)

论文首页
WTX (Wilms Tumor gene on the X chromosome) 是在Wilms 瘤中发现的首个定位于 X 染色体的抑癌基因。WTX 基因的单次突变及失活,将导致该基因的沉默,也就是所谓的“一次打击失活假说(one-hit hypothesis)”。这种抑癌基因失活方式是对“二次突变失活假说(two-hit hypothesis)” 的重要补充。有限的研究发现WTX基因通过抑制β-catenin或与APC相互作用来调控WNT通路活性,在胚胎发育和器官形成等方面发挥作用。WTX失活与Wilms瘤和颅骨硬化性纹状体骨病变(OSCS)发生有关,但是WTX在其他肿瘤中的作用尚不清楚。
该研究通过大量的细胞实验和动物模型及结直肠癌组织标本验证,首次证明WTX在抑制结直肠癌进展和肝转移过程中发挥重要作用,并揭示mir-20a/106a异常上调导致WTX在结直肠癌中失活,破坏小分子GTP酶调节因子RhoGDIa对CDC42的结合,引发CDC42与RhoGDIa解离,使CDC42从GDP结合的非活性状态转化成GTP结合的活性状态,从而活化CDC42调节轴,激活其下游的MRCKa, LIMK1/2和Cofilin分子,形成CDC42及其下游MRCKa-LIMK-Cofilin信号通路的级联激活,引起细胞骨架蛋白重构,细胞极化并移动能力增强,促进结直肠癌进展和肝转移。该研究为揭示X染色体上的基因在癌症进展中的作用、肝转移机制以及抗结直肠癌肝转移研究等方面提供了新的策略。
南方医科大学病理学系张庆玲和丁彦青为论文通讯作者,朱桂芳、徐阳微、李健和牛会林为共同一作者。课题受国家自然科学基金和广东省自然科学基金等经费资助。
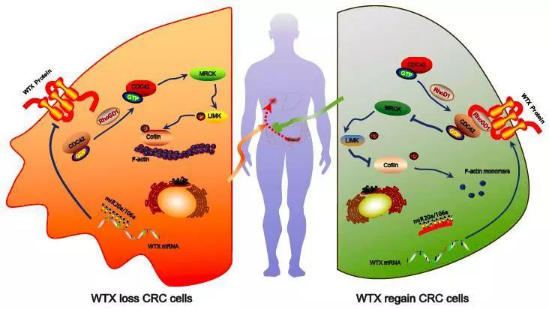
WTX失活介导结直肠癌肝转移机制模式图